Aldehidi su organske supstance koje se odnose na karbonilna jedinjenja koja sadrže funkcionalnu grupu -CH, koja se naziva karbonilna grupa.
U zavisnosti od prirode skeleta ugljikovodika molekule, aldehidi su zasićeni, nezasićeni i aromatični. Njihovi molekuli također mogu uključivati atome halogena ili dodatne funkcionalne grupe. Opšta formula za zasićene aldehide je C H2 O. U skladu sa IUPAC nomenklaturom, njihova imena završavaju sufiksom -al.
Oksidacija aldehida je važna u industriji jer se oni prilično lako pretvaraju u karboksilne kiseline. U ovom slučaju, bakar hidroksid, srebrni oksid ili čak atmosferski kiseonik mogu poslužiti kao oksidanti.
Struktura karbonilne grupe
Elektronsku strukturu dvostruke veze u C=O grupi karakteriše formiranje jedne σ-veze i još jedne π-veze. Atom C je u stanju sp2-hibridizacije, planarni molekul sa uglovima veze između veza od oko 1200. Razlika između dvostruke veze u ovoj funkcionalnoj grupi leži u činjenici da se nalazi između atoma ugljika i visoko elektronegativnog atoma kisika. Kao rezultatelektroni privlače O atom, što znači da je ova veza vrlo jako polarizirana.
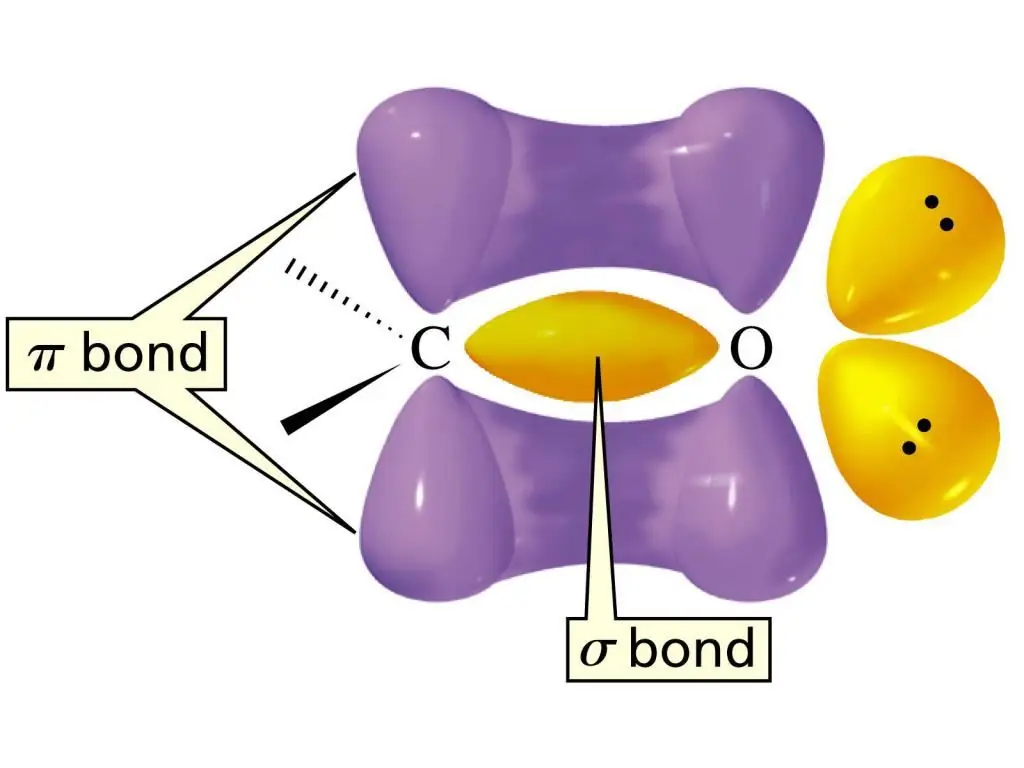
Sadržaj takve polarizovane dvostruke veze u aldehidnoj grupi može se nazvati glavnim razlogom visoke reaktivnosti aldehida. Za aldehide su najkarakterističnije reakcije dodavanja atoma ili njihovih grupa na vezu C=O. A reakcije nukleofilne adicije se najlakše odvijaju. Tipične za aldehide su i reakcije koje uključuju H atome iz funkcionalne grupe aldehida. Zbog efekta povlačenja elektrona C=O grupe, polaritet veze se povećava. Ovo je pak razlog za relativno laku oksidaciju aldehida.
Neki predstavnici aldehida
Formaldehid (formaldehid ili metanal) CH2O je gasovita supstanca veoma oštrog mirisa, koja se obično dobija propuštanjem mešavine para metanola sa vazduhom kroz crvenu -vruća mreža od bakra ili srebra. Njegov 40% vodeni rastvor naziva se formalin. Formaldehid lako ulazi u reakcije, od kojih su mnoge u osnovi industrijske sinteze niza važnih supstanci. Koristi se i za dobijanje izoprenske gume, pentaeritritola, mnogih lekovitih supstanci, raznih boja, za štavljenje kože, kao dezinfekciono sredstvo i dezodorans. Formaldehid je prilično toksičan, njegova MPC u zraku je 0,001 mg/l.
Acetaldehid (octeni aldehid, etanal) CH3SON je bezbojna tečnost zagušljivog mirisa, koja, kada se razblaži vodom, dobijavoćna aroma. Acetaldehid ima sva osnovna svojstva aldehida. Oksidacijom acetaldehida nastaju ogromne količine octene kiseline i anhidrida sirćetne kiseline, raznih farmaceutskih proizvoda.
Acrolein (propenal) CH2=CH-SON, najjednostavniji nezasićeni aldehid, je bezbojna, isparljiva tečnost. Njegove pare snažno iritiraju sluzokožu očiju i gornjih disajnih puteva. Veoma otrovan, MPC njegovog sadržaja u vazduhu je 0,7 mg/m3. Propenal je međuproizvod u sintezi određenih polimera i potreban je u proizvodnji određenih lijekova.

Benzaldehid (benzojev aldehid) S6N5SON je bezbojna tečnost koja postaje žuta tokom skladištenja sa aromom gorkog badema. Vrlo brzo se oksidira zrakom u benzojevu kiselinu. Sadrži u esencijalnim uljima biljaka (neroli, pačuli), a u obliku glukozida - u jezgri sjemenki gorkog badema, trešanja, kajsije i breskve. Kao mirisna supstanca koristi se u parfimeriji, kao komponenta prehrambenih esencija, kao sirovina za sintezu drugih mirisnih supstanci (cinamaldehid, jasminaldehid).
Reakcija srebrnog ogledala
Oksidacija aldehida srebrnim oksidom je najznačajnija kvalitativna reakcija na odgovarajući oblik funkcionalne grupe. Ova reakcija je dobila ime po tankom srebrnom premazu na zidovima epruvete, koji se formira tokom ove reakcije.
Njegova suština leži u interakciji aldehida R-COH sa amonijačnim rastvorom oksidasrebro(I), koje je rastvorljivo kompleksno jedinjenje [Ag(NH3)2]OH i naziva se Tollensov reagens. Reakcija se odvija na temperaturama blizu tačke ključanja vode (80-100 °C). U ovom slučaju, aldehidi se oksidiraju do odgovarajućih karboksilnih kiselina, a oksidacijski agens se reducira u metalno srebro, koje se taloži.
Priprema reagensa
Za kvalitativno određivanje -SON grupe u aldehidima, prvo se priprema jedinjenje kompleksa srebra. Da biste to učinili, u epruvetu se sipa malo otopine amonijaka (amonijum hidroksida) u vodi, a zatim i mala količina srebrovog nitrata. U ovom slučaju, nastali talog srebrnog oksida odmah nestaje:
2AgNO3 + 2NH3 + H2O -> Ag 2O↓ + 2NH4NO3
Ag2O + 4NΗ3 + Η2O -> 2[Ag (NΗ3)2]OΗ
Pouzdanije rezultate daje Tollensov reagens pripremljen sa alkalijom. Da bi se to uradilo, 1 g AgNO3 se rastvori u 10 g destilovane vode i doda se jednaka zapremina koncentrovanog natrijum hidroksida. Kao rezultat, taloži se precipitat Ag2O, koji nestaje kada se doda koncentrovani rastvor amonijum hidroksida. Za reakciju treba koristiti samo svježe pripremljeni reagens.

Mehanizam reakcije
Reakcija srebrnog ogledala odgovara jednadžbi:
2[Ag(NΗ3)2]OΗ + NSOΗ-> 2Ag↓ + ΗCOONΗ4 + 3NΗ3 + H2O
Vrijedi napomenuti da za aldehide ova interakcija nije dovoljno proučavana. Mehanizam ove reakcije je nepoznat, ali se pretpostavlja varijanta radikalne ili ionske oksidacije. Hidroksid diamin srebra se najvjerovatnije podvrgava adiciji sa formiranjem srebrne soli diola, iz koje se srebro zatim odcijepi da nastane karboksilna kiselina.
Čistoća pribora koji se koristi je izuzetno važna za uspješan eksperiment. To je zbog činjenice da bi čestice koloidnog srebra nastale tokom eksperimenta trebale prianjati za staklenu površinu, stvarajući površinu ogledala. U prisustvu najmanje kontaminacije, istaložiće se kao sivi flokulentni talog.
Alkalne otopine treba koristiti za čišćenje posude. Dakle, u ove svrhe možete uzeti otopinu NaOH, koja se mora isprati velikom količinom destilovane vode. Staklena površina mora biti očišćena od masnoće i mehaničkih čestica.
Oksidacija sa bakar hidroksidom
Reakcija oksidacije aldehida sa bakar (II) hidroksidom je takođe prilično efikasna i efikasna u određivanju vrste funkcionalne grupe. Nastavlja se na temperaturi koja odgovara ključanju reakcione smjese. U isto vrijeme, aldehidi reduciraju dvovalentni bakar u Fehlingovom reagensu (svježe pripremljeni rastvor amonijaka Cu(OH)2) u monovalentni bakar. Oni se sami oksidiraju zbog uvođenja atoma kisika u vezu C-H (oksidacijsko stanje C mijenja se od +1 do +3).
Vizuelno iza potezareakcije se mogu pratiti promjenom boje mješavine otopina. Plavkasti precipitat bakar hidroksida postepeno postaje žut, što odgovara monovalentnom bakar hidroksidu i dalju pojavu svetlo crvenog taloga Cu2O.
Ovaj proces odgovara jednadžbi reakcije:
R-SLEEP + Cu2+ + NaOH + H2O -> R-COONa + Cu 2O + 4H+

Akcija sa Jonesovim reagensom
Vrijedi napomenuti da takav reagens djeluje na najbolji način na aldehide. U ovom slučaju, oksidacija ne zahtijeva zagrijavanje i provodi se na temperaturi od 0-20 °C u prilično kratkom vremenskom periodu, a prinos proizvoda je veći od 80%. Glavni nedostatak Jonesovog reagensa je nedostatak visoke selektivnosti za druge funkcionalne grupe, a osim toga, kiselo okruženje ponekad dovodi do izomerizacije ili destrukcije.
Jones reagens je rastvor hrom (VI) oksida u razblaženoj sumpornoj kiselini i acetonu. Može se dobiti i iz natrijum dihromata. Kada se aldehidi oksidiraju, pod djelovanjem ovog reagensa nastaju karboksilne kiseline.
Industrijska oksidacija kiseonikom
Oksidacija acetaldehida u industriji se odvija djelovanjem kisika u prisustvu katalizatora - jona kob alta ili mangana. Prvo se formira peroctena kiselina:
CH3-SLEEP + O2 -> CH3-UNOH
Ona, zauzvrat, stupa u interakciju sa drugim molekulom acetaldehida i preko peroksidajedinjenje daje dva molekula sirćetne kiseline:
CH3-COOH + CH3-SON -> 2CH3-COOH
Oksidacija se vrši na temperaturi od 60-70 °C i pritisku od 2 105 Pa.
Interakcija sa rastvorom joda
Za oksidaciju aldehidnih grupa ponekad se koristi rastvor joda u prisustvu alkalija. Ovaj reagens je od posebnog značaja u procesu oksidacije ugljikohidrata, jer djeluje vrlo selektivno. Dakle, pod njegovim uticajem, D-glukoza se pretvara u D-glukonsku kiselinu.
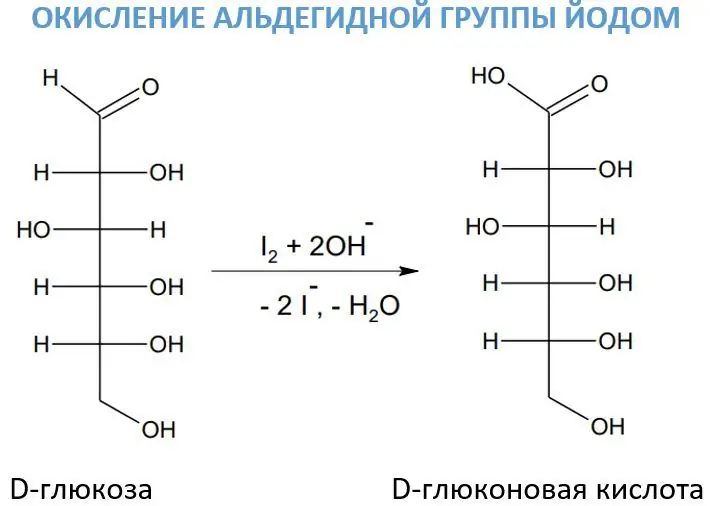
Jod u prisustvu alkalija stvara hipojodid (veoma jak oksidant):.
Pod dejstvom hipojodida formaldehid se pretvara u metansku kiselinu: ΗSOΗ + NaIO + NaOΗ -> ΗCOONa + NaI + H2O.
Oksidacija aldehida jodom se koristi u analitičkoj hemiji za određivanje njihovog kvantitativnog sadržaja u rastvorima.
Oksidacija selen-dioksidom
Za razliku od prethodnih reagenasa, pod dejstvom selen-dioksida aldehidi se pretvaraju u dikarbonilna jedinjenja, a iz formaldehida nastaje glioksal. Ako se metilenske ili metilne grupe nalaze pored karbonila, tada se mogu pretvoriti u karbonil. Dioksan, etanol ili ksilen se obično koriste kao rastvarači za SeO2.
Prema jednoj metodi, reakcija se izvodi u tikvici sa tri vrata koja je povezana sa mešalicom, termometrom i refluks kondenzatorom. Početnoj tvari, uzetoj u količini od 0,25 mola, dodaje se otopina u kapima0,25 mol selen dioksida u 180 ml dioksana, kao i 12 ml H2O. Temperatura ne bi trebalo da prelazi 20 °C (ako je potrebno, ohladite tikvicu). Nakon toga, uz stalno mešanje, rastvor se kuva 6 sati. Zatim se vrući rastvor filtrira da se odvoji selen i talog se ispere dioksanom. Nakon vakuumske destilacije rastvarača, ostatak se frakcioniše. Glavna frakcija se uzima u širokom temperaturnom rasponu (20-30 °C) i ponovo se reriguje.
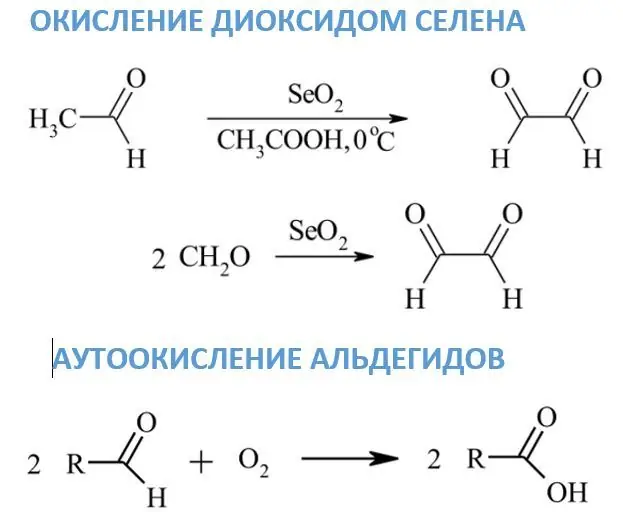
Autooksidacija aldehida
Pod dejstvom atmosferskog kiseonika na sobnoj temperaturi, oksidacija aldehida se odvija veoma sporo. Glavni produkti ovih reakcija su odgovarajuće karboksilne kiseline. Mehanizam autooksidacije povezan je s industrijskom oksidacijom etanala u octenu kiselinu. Jedan od intermedijera je perkiselina koja reaguje sa drugim molekulom aldehida.
Zbog činjenice da ovu vrstu reakcije ubrzavaju svjetlost, peroksidi i tragovi teških metala, može se zaključiti da je njen radikalni mehanizam. Formaldehid u vodenim rastvorima oksidira se vazduhom mnogo lošije od svojih kolega, zbog činjenice da postoji u njima u obliku hidratisanog metilen glikola.

Oksidacija aldehida sa kalijum permanganatom
Ova reakcija je najuspješnija u kiseloj sredini. Njegov prolaz možete vizualno procijeniti gubitkom intenziteta i potpunom promjenom ružičaste boje otopine kalijum permanganata. Reakcija se odvija usobnoj temperaturi i normalnom pritisku, tako da ne zahteva posebne uslove. U epruvetu je dovoljno uliti 2 ml formaldehida i 1 ml rastvora kalijum permanganata zakiseljenog sumpornom kiselinom. Lagano protresite epruvetu s otopinom da se reagensi pomiješaju:
5CH3-SLEEP + 2KMnO4 + 3H2SO 4 =5CH3-COOH + 2MnSO4 + K2SO 4 + 3H2O
Ako se ista reakcija izvodi na povišenim temperaturama, tada se metanal lako oksidira u ugljični dioksid:
5CH3-SLEEP + 4KMnO4 + 6H2SO 4 =5SO2 + 4MnSO4 + 2K2SO 4 + 11N2O






