Proučavanje svojstava idealnog gasa je važna tema u fizici. Uvod u karakteristike gasnih sistema počinje razmatranjem Boyle-Mariotteove jednačine, budući da je to prvi eksperimentalno otkriven zakon idealnog gasa. Razmotrimo to detaljnije u članku.
Šta se podrazumeva pod idealnim gasom?
Prije govora o Boyle-Mariotteovom zakonu i jednadžbi koja ga opisuje, hajde da definiramo idealni plin. Obično se shvata kao fluidna supstanca u kojoj čestice koje je čine ne interaguju jedna s drugom, a njihove veličine su zanemarljivo male u poređenju sa prosečnim rastojanjem između čestica.
U stvari, svaki plin je stvaran, odnosno, njegovi sastavni atomi i molekuli imaju određenu veličinu i ne stupaju u interakciju jedni s drugima uz pomoć van der Waalsovih sila. Međutim, pri visokim apsolutnim temperaturama (više od 300 K) i niskim pritiscima (manje od jedne atmosfere), kinetička energija atoma i molekula je mnogo veća od energije van der Waalsovih interakcija, pa je pravi plin na naznačenojuslovi visoke preciznosti mogu se smatrati idealnim.
Boyle-Mariotteova jednadžba
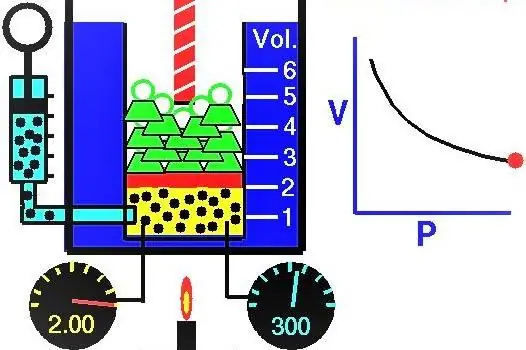
Svojstva gasova evropski naučnici su aktivno istraživali tokom XVII-XIX veka. Prvi gasni zakon koji je eksperimentalno otkriven bio je zakon koji opisuje izotermne procese širenja i kompresije gasnog sistema. Odgovarajuće eksperimente izveli su Robert Boyle 1662. i Edm Mariotte 1676. godine. Svaki od ovih naučnika nezavisno je pokazao da se tokom izotermnog procesa u zatvorenom gasnom sistemu pritisak menja obrnuto sa zapreminom. Eksperimentalno dobijeni matematički izraz procesa zapisuje se u sljedećem obliku:
PV=k
Gde su P i V pritisak u sistemu i njegova zapremina, k je neka konstanta, čija vrednost zavisi od količine gasne supstance i njene temperature. Ako gradite ovisnost funkcije P(V) na grafu, onda će to biti hiperbola. Primjer ovih krivulja je prikazan ispod.
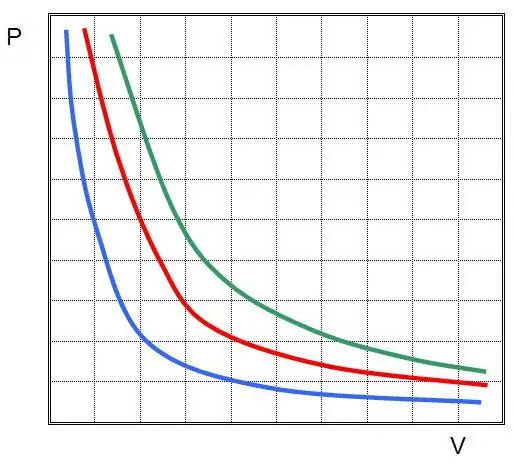
Napisana jednakost se naziva Boyle-Mariotteova jednačina (zakon). Ovaj zakon se može ukratko formulirati na sljedeći način: širenje idealnog plina na konstantnoj temperaturi dovodi do proporcionalnog smanjenja tlaka u njemu, naprotiv, izotermna kompresija plinskog sustava praćena je proporcionalnim povećanjem tlaka u njemu.
Idealna gasna jednačina
Boyle-Mariotteov zakon je poseban slučaj općenitijeg zakona koji nosi imena Mendeljejeva iClapeyron. Emile Clapeyron, sumirajući eksperimentalne informacije o ponašanju gasova u različitim spoljašnjim uslovima, 1834. godine dobija sledeću jednačinu:
PV=nRT
Drugim rečima, proizvod zapremine V gasnog sistema i pritiska P u njemu direktno je proporcionalan proizvodu apsolutne temperature T i količine supstance n. Koeficijent ove proporcionalnosti označen je slovom R i naziva se plinska univerzalna konstanta. U pisanoj jednačini, vrijednost R se pojavila zbog zamjene određenog broja konstanti, koju je napravio Dmitrij Ivanovič Mendeljejev 1874.
Iz univerzalne jednadžbe stanja lako je vidjeti da konstantnost temperature i količine supstance garantuje invarijantnost desne strane jednačine, što znači da će i lijeva strana jednadžbe ostati konstantna. U ovom slučaju, dobijamo Boyle-Mariotteovu jednačinu.

Drugi zakoni o plinu
Clapeyron-Mendeleev jednadžba napisana u gornjem pasusu sadrži tri termodinamička parametra: P, V i T. Ako je svaki od njih fiksiran, a druga dva se mogu mijenjati, onda ćemo dobiti Boyle-Mariotte, Charles i Gay-Lussac jednadžbe. Charlesov zakon govori o direktnoj proporcionalnosti između zapremine i temperature za izobarični proces, a Gay-Lussacov zakon kaže da se u slučaju izohornog prijelaza tlak plina povećava ili smanjuje u direktnoj proporciji sa apsolutnom temperaturom. Odgovarajuće jednačine izgledaju ovako:
V/T=const kada je P=const;
P/T=const kada je V=const.
DakleDakle, Boyle-Mariotteov zakon je jedan od tri glavna zakona o plinu. Međutim, razlikuje se od ostalih u smislu grafičke zavisnosti: funkcije V(T) i P(T) su prave linije, funkcija P(V) je hiperbola.
Primjer zadatka za primjenu Boyle-Mariotteovog zakona
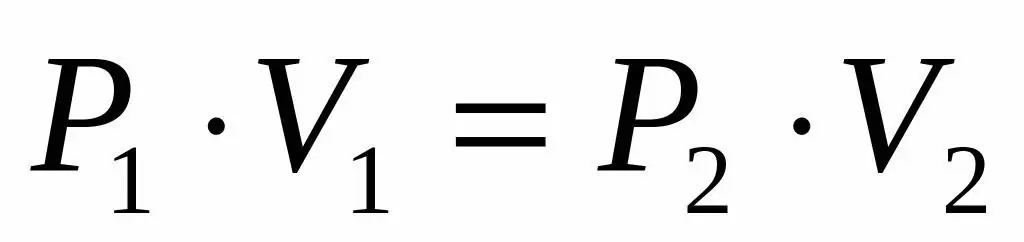
Zapremina gasa u cilindru ispod klipa u početnoj poziciji bila je 2 litre, a pritisak 1 atmosfera. Koliki je bio pritisak gasa nakon podizanja klipa i povećanja zapremine gasnog sistema za 0,5 litara. Proces se smatra izotermnim.
Pošto su nam dati pritisak i zapremina idealnog gasa, a takođe znamo da temperatura ostaje nepromenjena tokom njegovog širenja, možemo koristiti Boyle-Mariotteovu jednačinu u sledećem obliku:
P1V1=P2V 2
Ova jednakost kaže da je proizvod volumen-pritisak konstantan za svako stanje gasa na datoj temperaturi. Izražavajući vrijednost P2 iz jednakosti, dobijamo konačnu formulu:
P2=P1V1/V 2
Kada radite proračune pritiska, u ovom slučaju možete koristiti vansistemske jedinice, jer će se litri smanjiti, a dobijamo pritisak P2u atmosferama. Zamjenom podataka iz uslova dolazimo do odgovora na pitanje zadatka: P2=0,8 atmosfera.






