Jedno od važnih pitanja u proučavanju termodinamičkih sistema u fizici je pitanje da li ovaj sistem može obaviti neki koristan posao. Usko povezan sa konceptom rada je koncept unutrašnje energije. U ovom članku ćemo razmotriti kolika je unutrašnja energija idealnog plina i dati formule za njeno izračunavanje.
Idealni plin
O plinu, kao agregacijskom stanju, koje nema nikakvu elastičnu silu pod vanjskim utjecajem na njega i kao rezultat toga, ne zadržava volumen i oblik, zna svaki školarac. Koncept idealnog gasa za mnoge ostaje nerazumljiv i nejasan. Hajde da to objasnimo.
Idealni plin je svaki plin koji zadovoljava sljedeća dva važna uslova:
- Čestice koje ga čine nemaju veličinu. Imaju veličinu, ali je toliko mala u poređenju sa udaljenostima između njih da se može zanemariti u svim matematičkim proračunima.
- Čestice ne stupaju u interakciju jedna s drugom korištenjem van der Waalsovih sila ili siladruga priroda. U stvari, u svim stvarnim gasovima, takva interakcija je prisutna, ali je njena energija zanemarljiva u poređenju sa prosečnom energijom kinetičkih čestica.
Opisanim uslovima zadovoljavaju skoro svi stvarni gasovi, čije su temperature iznad 300 K, a pritisci ne prelaze jednu atmosferu. Za previsoke pritiske i niske temperature uočava se odstupanje gasova od idealnog ponašanja. U ovom slučaju se govori o pravim gasovima. Oni su opisani van der Waalsovom jednačinom.
Koncept unutrašnje energije idealnog gasa
U skladu sa definicijom, unutrašnja energija sistema je zbir kinetičke i potencijalne energije sadržane u ovom sistemu. Ako se ovaj koncept primjenjuje na idealan plin, tada potencijalnu komponentu treba odbaciti. Zaista, pošto čestice idealnog gasa ne interaguju jedna s drugom, može se smatrati da se slobodno kreću u apsolutnom vakuumu. Da bi se izdvojila jedna čestica iz sistema koji se proučava, nije potrebno raditi protiv unutrašnjih sila interakcije, jer te sile ne postoje.
Dakle, unutrašnja energija idealnog gasa uvek se poklapa sa njegovom kinetičkom energijom. Potonji je, zauzvrat, jedinstveno određen molarnom masom čestica sistema, njihovim brojem, kao i prosječnom brzinom translacijskog i rotacijskog kretanja. Brzina kretanja zavisi od temperature. Povećanje temperature dovodi do povećanja unutrašnje energije, i obrnuto.
Formula zaunutrašnja energija
Označite unutrašnju energiju idealnog gasnog sistema slovom U. Prema termodinamici, ona se definiše kao razlika između entalpije H sistema i proizvoda pritiska i zapremine, odnosno:
U=H - pV.
U gornjem paragrafu smo saznali da vrijednost U odgovara ukupnoj kinetičkoj energiji Eksvih čestica plina:
U=Ek.
Iz statističke mehanike, u okviru molekularne kinetičke teorije (MKT) idealnog gasa, sledi da je prosečna kinetička energija jedne čestice Ek1 jednaka sljedeća vrijednost:
Ek1=z/2kBT.
Ovdje kB i T - Boltzmannova konstanta i temperatura, z - broj stupnjeva slobode. Ukupna kinetička energija sistema Ek može se dobiti množenjem Ek1 sa brojem čestica N u sistemu:
Ek=NEk1=z/2NkBT.
Tako smo dobili formulu za unutrašnju energiju idealnog gasa, napisanu u opštem obliku u smislu apsolutne temperature i broja čestica u zatvorenom sistemu:
U=z/2NkBT.
Monatomski i poliatomski plin
Formula za U napisana u prethodnom pasusu članka je nezgodna za njenu praktičnu upotrebu, jer je teško odrediti broj čestica N. Međutim, ako uzmemo u obzir definiciju količine supstance n, onda se ovaj izraz može prepisati u pogodnijem obliku:
n=N/NA; R=NAkB=8, 314 J/(molK);
U=z/2nR T.
Broj stepeni slobode z zavisi od geometrije čestica koje čine gas. Dakle, za jednoatomni gas, z=3, pošto se atom može samostalno kretati samo u tri pravca prostora. Ako je gas dvoatomski, onda je z=5, pošto se trima translacionim stepenom slobode dodaju još dva rotirajuća stepena slobode. Konačno, za bilo koji drugi poliatomski plin, z=6 (3 translacijska i 3 rotirajuća stupnja slobode). Imajući to na umu, možemo u sljedećem obliku napisati formule za unutrašnju energiju idealnog plina jednoatomnog, dvoatomnog i poliatomskog:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Primjer zadatka za određivanje unutrašnje energije
Boca od 100 litara sadrži čisti vodonik pod pritiskom od 3 atmosfere. Uz pretpostavku da je vodonik idealan gas pod datim uslovima, potrebno je odrediti kolika je njegova unutrašnja energija.

Gore formule za U sadrže količinu supstance i temperaturu gasa. U uslovima problema o ovim količinama se ne govori apsolutno ništa. Da bismo riješili problem, potrebno je prisjetiti se univerzalne Clapeyron-Mendelejevske jednadžbe. Ima izgled prikazan na slici.
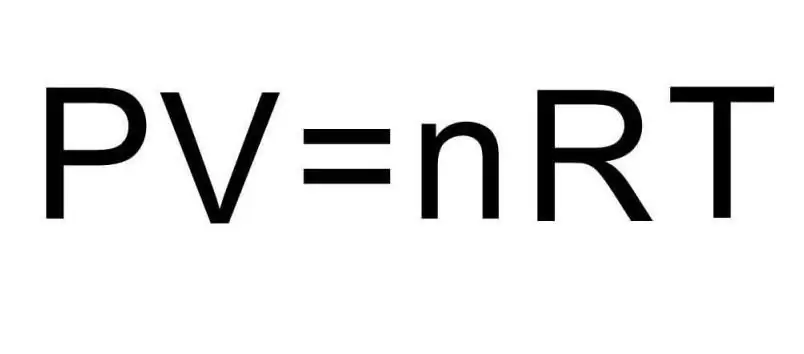
Pošto je vodonik H2 dvoatomska molekula, formula za unutrašnju energiju je:
UH2=5/2nRT.
Upoređujući oba izraza, dolazimo do konačne formule za rješavanje problema:
UH2=5/2PV.
Ostaje konvertovati jedinice pritiska i zapremine iz stanja u SI sistem jedinica, zameniti odgovarajuće vrednosti u formuli za UH2 i dobiti odgovor: UH2 ≈ 76 kJ.






