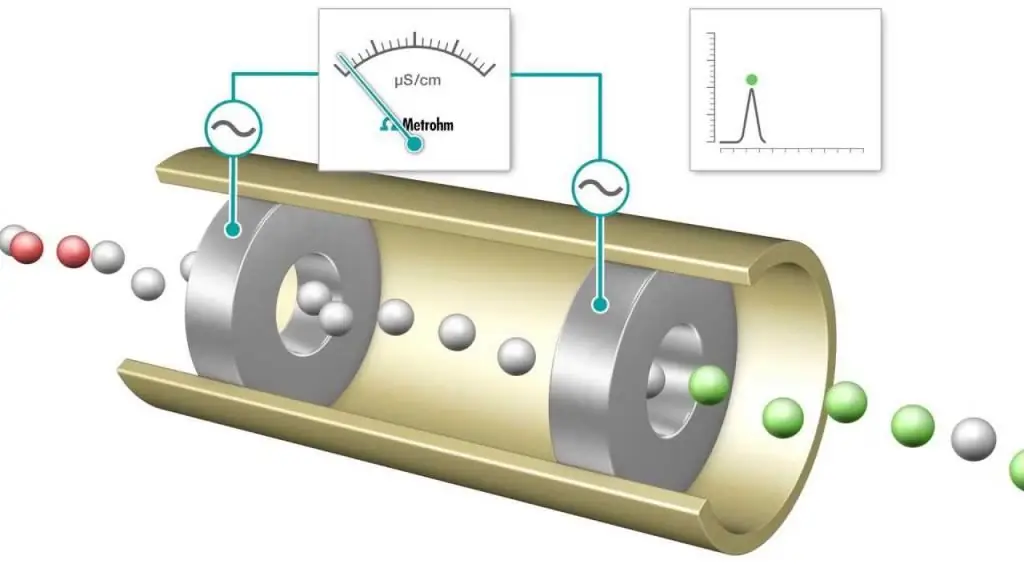
Konduktometrijska metoda analize je mjerenje elektrolitičke provodljivosti za praćenje toka kemijske reakcije. Ova nauka ima široku primenu u analitičkoj hemiji, gde je titracija standardna metoda rada. Šta je konduktometrija? U uobičajenoj praksi u analitičkoj hemiji, termin se koristi kao sinonim za titraciju, a koristi se i za opisivanje netitracionih aplikacija. Koja je korist od korištenja ove metode analize? Često se koristi za određivanje ukupne provodljivosti rastvora ili za analizu krajnje tačke titracije koja uključuje jone.
Historija
Konduktivna merenja počela su još u 18. veku, kada je Andreas Baumgartner primetio da slana i mineralna voda iz Bad Gaštajna uAustrija provodi struju. Tako je upotreba ove metode za određivanje čistoće vode, koja se danas često koristi za ispitivanje efikasnosti sistema za prečišćavanje vode, počela 1776. godine. Tako je počela istorija konduktometrijske metode analize.
Friedrich Kohlrausch je nastavio razvoj ove nauke 1860-ih, kada je primijenio naizmjeničnu struju na vodu, kiseline i druga rješenja. Otprilike u to vrijeme, Willis Whitney, koji je proučavao interakcije kompleksa sumporne kiseline i krom sulfata, pronašao je prvu konduktometrijsku krajnju tačku. Ovi nalazi su kulminirali potenciometrijskom titracijom i prvim instrumentom za volumetrijsku analizu Roberta Behrenda 1883. godine u titraciji hlorida i bromida HgNO3. Dakle, moderna konduktometrijska metoda analize zasnovana je na Behrendu.
Ovaj razvoj je omogućio ispitivanje rastvorljivosti soli i koncentracije vodikovih jona, kao i acidobazne i redoks titracije. Konduktometrijska metoda analize je poboljšana razvojem staklene elektrode, koji je započeo 1909.
Titacija
Konduktometrijska titracija je mjerenje u kojem se elektrolitička provodljivost reakcione smjese kontinuirano prati dodavanjem jednog reagensa. Ekvivalentna tačka je tačka u kojoj se provodljivost naglo menja. Primjetno povećanje ili smanjenje provodljivosti povezano je s promjenom koncentracije dva najvodljivija iona, vodikovih i hidroksidnih iona. Ova metodamože se koristiti za titriranje obojenih otopina ili homogene suspenzije (npr. suspenzije drvne pulpe) koja se ne može koristiti s konvencionalnim indikatorima.
Acid-bazne i redoks titracije se često izvode, koje koriste uobičajene indikatore za određivanje krajnje tačke, kao što su metil narandžasta, fenolftalein za kiselo-baznu titraciju i rastvori škroba za jodometrijski tip redoks procesa. Međutim, mjerenja električne provodljivosti mogu se koristiti i kao alat za određivanje krajnje tačke, na primjer kada se posmatra otopina HCl sa jakom bazom NaOH.
Neutralizacija protona
Kako titracija napreduje, protoni se neutraliziraju i formiraju NaOH formiranjem vode. Za svaku dodanu količinu NaOH, uklanja se ekvivalentan broj vodikovih jona. U stvari, mobilni H+ kation je zamijenjen manje pokretnim Na+ jonom, a provodljivost titrirane otopine, kao i izmjerena provodljivost ćelije, se smanjuju. Ovo se nastavlja sve dok se ne postigne tačka ekvivalencije u kojoj se može dobiti rastvor natrijum hlorida NaCl. Ako se doda više baze, dolazi do povećanja kako se dodaje više Na+ i OH- jona i reakcija neutralizacije više ne uklanja značajnu količinu H+.

Slijedom toga, kada se jaka kiselina titrira jakom bazom, provodljivost ima minimum u tački ekvivalencije. Ovaj minimummože se koristiti umjesto indikatorske boje za određivanje krajnje točke titracije. Kriva titracije je graf izmjerenih vrijednosti provodljivosti ili provodljivosti kao funkcije volumena dodane otopine NaOH. Kriva titracije se može koristiti za grafičko određivanje tačke ekvivalencije. Konduktometrijska metoda analize (i njena upotreba) izuzetno je relevantna u modernoj hemiji.
Reakcija
Za reakciju između slabe kiseline i slabe baze, električna provodljivost se prvo donekle smanjuje, budući da se koristi malo dostupnih H+ jona. Tada se provodljivost lagano povećava do zapremine tačke ekvivalencije zbog doprinosa kationa soli i anjona (ovaj doprinos u slučaju jake kisele baze je zanemariv i tu se ne uzima u obzir.) Nakon što se postigne tačka ekvivalencije, provodljivost se brzo povećava zbog viška OH jona.
Detektori provodljivosti (konduktometrijska metoda analize) se također koriste za mjerenje koncentracija elektrolita u vodenim otopinama. Molarna koncentracija analita koji stvara provodljivost otopine može se dobiti iz izmjerenog električnog otpora otopine.
Konduktometrijska metoda analize: princip i formule
(2.4.13) C=Constcell1Λm1Res, gdje je Constcell konstantna vrijednost u zavisnosti od mjerne ćelije, Res je električni otpor koji mjeri uređaj (prema Ohmovom zakonu Res=I/V, i sa konstantom Napon V mjerenje I intenziteta vam omogućava da izračunate Res), a Λm je ekvivalentprovodljivost za jonske čestice. Iako se u praktične svrhe Λm može smatrati konstantnim, on ovisi o koncentraciji prema Kohlrauschovom zakonu:
(2.4.14)=Ht Λm0-ΘC, gdje je Θ konstanta, a Λm0 je granična molarna provodljivost karakteristika svakog jona. Molarna provodljivost, zauzvrat, zavisi od temperature.
Scrit
Razvoj konduktometrijske metode mjerne analize doveo je naučnike do novih otkrića. Naučnici su odredili kritični omjer prezasićenja, Scrit, koristeći konduktometriju u homogenom sistemu precipitacije AgCl u višku Ag+ jona, koristeći hidrolizu alkil hlorida kao izvora CI jona.” Našli su Scrit=1,51, 1,73 i 1,85 na 15, 25 i 35°C respektivno, gdje je S=([Ag+][Cl-] / Ksp) 1/2 po njihovoj definiciji. Ako se ova definicija faktora prezasićenosti pretvori u našu (S=[Ag+][Cl-] / Ksp), rezultati su 2,28, 2,99 i 3,42, respektivno, u prilično dobroj saglasnosti sa rezultatima ove studije. Međutim, temperaturna ovisnost Scrit-a je suprotna onoj opisanoj u ovoj studiji. Iako razlog za ovu kontradikciju nije jasan, smanjenje Scrit s povećanjem temperature može biti sasvim razumno, budući da se brzina nukleacije dramatično mijenja s malom promjenom ΔGm/ kT, a time i ΔGm/ kT, što je proporcionalno T − 3 (lnSm) 2 prema formuli (1.4.12) smatra se skoro konstantnim sa promenom temperature u datom sistemu. Uzgred, definicija S mora biti [Ag +] [Cl -] / Ksp, budući da je omjer prezasićenja u smisluKoncentracija [AgCl] monomera je u početku data kao S=[AgCl] / [AgCl] (∞)=[Ag +] [Cl -] / Ksp.
Tanaka i Iwasaki
Historiju konduktometrijske metode analize nastavila su dva legendarna japanska naučnika. Tanaka i Iwasaki proučavali su proces nukleacije čestica AgCl i AgBr metodom zaustavljenog toka u kombinaciji sa višekanalnim spektrofotometrom, što je korisno za proučavanje brzog procesa reda veličine msec. Otkrili su da je neki specifični srebrni halogenidni kompleks AgXm (m-1), koji ima prilično usku UV apsorpcionu traku, nastao trenutno kada se otopina AgC104 reda veličine 10-4 mol dm-3 pomiješa s KX (X=Cl ili Br) otopina reda veličine od 10-2 do 10-1 mol dm-3 nakon čega slijedi njegovo brzo raspadanje od oko 10 ms sa stvaranjem međuprodukta koji ima široku UV apsorpciju i mnogo sporiju promjenu spektra međuproizvoda. Intermedijer su interpretirali kao monodisperzna jezgra (AgX) n koja se sastoje od n molekula i odredili n iz prividnog omjera -dC/dt α Cn pri t=0 za različite početne koncentracije prekursora C AgXm (m-1) - (n=7 -10 za AgCl, n=3-4 za AgBr).

Međutim, budući da se prethodnik AgXm (m − 1) raspada na nestacionaran način, teorija kvazistacionarne nukleacije se ne primjenjuje u ovom procesu, pa stoga rezultirajuća vrijednost n ne odgovara nvrijednost kritičnih jezgara. Ako međuproizvod sadrži monodisperzne jezgre n,formiran od monomernog kompleksa, omjer -dC/dt α C možda neće biti održan. Osim ako pretpostavimo da su klasteri manji od n-mera u ravnoteži, ki − 1, ici − 1c1=ki, i − 1ci, jedan s drugim u sekvencijalnoj reakciji c1 → c2 → c3 →… → cn − 1 → cn., i samo posljednji korak cn − 1 → cn je nepovratan; tj. c1⇌c2⇌c3⇌… ⇌cn − 1 → cn.
Osim toga, treba pretpostaviti da koncentracije klastera od 2 do n-1 imaju zanemarljive ravnotežne koncentracije. Međutim, čini se da nema osnova za opravdanje ovih pretpostavki. S druge strane, pokušali smo izračunati polumjere kritičnih jezgara i koeficijente prezasićenosti S na kraju brzog procesa, koristeći γ=101 mJ m − 2 za kubni AgCl19 i γ=109 mJ m − 2 za kubni AgBr20, pod pretpostavkom da su vrijednosti n, 7-10 za AgCl19 i 3-4 za AgBr20, ekvivalentne veličini monodisperznih jezgara, n. Konduktometrijska metoda analize, čije se recenzije kreću od jednostavnog odobravanja do divljenja, dala je novo rođenje hemiji kao nauci.
Kao rezultat, naučnici su otkrili sledeću formulu: r=0,451 nm i S=105 za AgCl sa n=9; r=0,358 nm i S=1230 za AgBr sa n=4. Pošto su njihovi sistemi uporedivi sa onima od Davisa i Jonesa, koji su postigli kritično prezasićenje AgCl od oko 1,7-2,0 na 25 °C. Koristeći konduktometriju direktnog miješanja u jednakim količinama razrijeđenih vodenih otopina AgNO3 i KCl, ekstremno visoke vrijednosti S možda neće odražavati stvarne faktore prezasićenosti.u ravnoteži sa srednjim jezgrima.
UV apsorpcija
Čini se razumnijim pripisati intermedijer sa širokom UV apsorpcijom mnogo većim od prosječnih jezgara sa širokom distribucijom veličine koju generiše nestacionarna sekvencijalna reakcija. Čini se da je kasnija spora promjena intermedijarnih jezgara povezana s njihovim sazrijevanjem u Ostwaldu.

U gornjem kontekstu, američki hemičar Nielsen je također izveo sličan noko 12 i odgovarajući S veći od 103 za nukleaciju čestica barij sulfata iz mjerenja zamućenosti kao funkcije prezasićenja, koristeći n=dlogJ / dlogC u Becher-Deringovoj teoriji na formulu. (1.3.37), ali daje (n+ 1) umjesto n. Pošto su rastvori jona barijuma i sulfatnih jona direktno pomešani u ovom eksperimentu, brza prolazna nukleacija je trebalo da se završi odmah nakon mešanja, a ono što je izmereno mogla bi biti brzina sporog naknadnog Ostwaldovog sazrevanja i/ili fuzije generisanih jezgara. Očigledno je to razlog neopravdano male vrijednosti n i izuzetno visoke prezasićenosti. Stoga, opet moramo napomenuti da je za postizanje kvazistacionarne nukleacije u zatvorenom sistemu uvijek neophodan neki rezervoar monomernih vrsta koji ih oslobađa kao odgovor na njihovu potrošnju. Sve klasične teorije nukleacije, uključujući Becher-Döringovu teoriju, implicitno pretpostavljaju takav uslov. Definicija konduktometrijemetoda analize je data u odeljcima članka iznad.
Drugi naučnici su istraživali proces prolazne nukleacije srebrnog halogenida pulsnom radiolizom vode koja sadrži metilen halid i ione srebra, tokom koje se metilen halid razlaže kako bi se oslobodili halogenidni joni hidratisanim elektronima generisanim impulsnim zračenjem u opsegu od 4 ns do 3 μs. Spektri proizvoda su snimljeni pomoću fotomultiplikatora i streak kamere, a pronađeno je da se monomerni prekursori srebra halida formiraju tokom vremena reda veličine mikrosekundi, nakon čega je uslijedio proces nukleacije sličan onom koji su primijetili Tanaka i Iwasaki. Njihovi rezultati jasno pokazuju da se proces nukleacije srebrnih halogenida direktnim miješanjem reaktanata sastoji od dva elementarna koraka; odnosno formiranje monomernog prekursora reda μs i kasniji prijelaz na jezgra reda veličine 10 ms. Treba napomenuti da je prosječna veličina jezgara oko 10 nm.
Saturation
Što se tiče koeficijenata prezasićenosti za nukleaciju čestica AgCl u otvorenim sistemima u kojima se visoke koncentracije reaktanata kao što su AgNO3 i KCl kontinuirano uvode u rastvor želatina tokom taloženja, Strong i Wey31 su objavili 1,029 (80° C) - 1,260 (40°C) i Leubner32 su prijavili 1,024 na 60°C kako je procijenjeno iz mjerenja brzine rasta čestica sjemena AgCl pri kritičnom prezasićenju. Ovo je suština konduktometrijske metode kvantitativne analize.
S druge strane, za otvorene sisteme AgBr čestica, nekeprocijenjene vrijednosti kritičnog koeficijenta prezasićenosti, Scrit: Scrit∼- 1,5 na 70 °C prema Weyu i Strong33 iz maksimalne brzine rasta zavisne od veličine određene pronalaženjem praga renukleacije pri različitim brzinama dodavanja otopine AgNO3 u KBr rastvor u prisustvu čestica sjemena dvostrukim mlaznicama; Scrit=1,2-1,5 na 25°C prema Jagannathanu i Wey34 kao maksimalnom faktoru prezasićenosti određen iz Gibbs-Thomsonove jednadžbe sa njihovim podacima o minimalnoj prosječnoj veličini jezgara uočenih elektronskom mikroskopijom tokom koraka nukleacije dvomlaznog taloženja AgBr. Ovo je vrlo efikasno kada se primjenjuje konduktometrijska metoda kvantifikacije.

Kada su izračunate ove Scrit vrijednosti, uzeli su γ=140 mJ m − 2. Budući da nukleacija u otvorenim sistemima odgovara procesu preživljavanja novonastalih jezgara stvorenih u lokalnoj zoni izuzetno visoke prezasićenosti u blizini izlaza reaktanata, kritična je supersaturacija odgovara koncentraciji otopljene supstance u ravnoteži sa jezgrima maksimalne veličine, ako koristimo podatke Sugimoto35 o maksimalnom poluprečniku jezgara AgBr u otvorenim sistemima (.3 8,3 nm) sa teoretskim γ za kubni AgBr (=109 mJ m −).) 3, tada se kritični faktor prezasićenja, Scrit, izračunava kao 1,36 na 25°C (ako se pretpostavi da je γ 140 mJ/m2, tada je Scrit=1,48).
Slijedom toga, u svakom slučaju, kritična prezasićenja uotvoreni sistemi čestica srebrnog halogenida su obično znatno ispod maksimalnog prezasićenja (vjerovatno blizu kritičnog prezasićenja) u zatvorenim sistemima. To je zato što je prosječni polumjer jezgara generiranih u lokalnoj zoni otvorenog sistema mnogo veći od rmu zatvorenom sistemu, vjerovatno zbog trenutne fuzije visoko koncentriranih primarnih jezgara u lokalnoj zoni otvorenog sistema sa visokim lokalna koncentracija elektrolita.
Prijava
Upotreba metode konduktometrijske titracije za kontinuirano snimanje tokom enzimskih procesa je opsežno proučavana i analizirana. Gotovo sve elektrohemijske analitičke metode zasnivaju se na elektrohemijskim reakcijama (potenciometrija, voltametrija, amperometrija, kulometrija).
Konduktometrijska metoda analize je metoda u kojoj ili uopće nema elektrohemijskih reakcija na elektrodama, ili postoje sekundarne reakcije koje se mogu zanemariti. Stoga, u ovoj metodi, najvažnije svojstvo otopine elektrolita u graničnom sloju je njegova električna provodljivost, koja varira u zavisnosti od prilično širokog spektra bioloških reakcija.
Pogodnosti
Konduktometrijski biosenzori takođe imaju neke prednosti u odnosu na druge tipove pretvarača. Prvo, mogu se napraviti korištenjem jeftine standardne tehnologije tankog filma. Ovo, uz korištenje optimizirane metode za imobilizaciju biološkog materijala, dovodi do značajnog smanjenja i primarne cijene uređaja iukupni trošak analize. Za ugrađene mikrobiosenzore, lako je izvesti diferencijalni način mjerenja, koji kompenzira vanjske utjecaje i značajno poboljšava tačnost mjerenja.
Podaci jasno pokazuju veliki potencijal konduktometrijskih biosenzora. Međutim, ovo je još uvijek prilično nov trend u biosenzorima, tako da razvoj komercijalnih uređaja ima obećavajuću budućnost.
Nove metode
Neki naučnici su opisali opštu metodu za merenje pKa putem provodljivosti. Ova metoda je bila široko korištena do otprilike 1932. godine (prije nego što su korištene metode mjerenja pH). Konduktometrijska metoda je izuzetno osjetljiva na temperaturu i ne može se koristiti za mjerenje preklapajućih pKa vrijednosti. Moguća prednost za uzorke bez hromofora je to što se može koristiti u vrlo razrijeđenim otopinama, do 2,8 × 10-5 M. Posljednjih godina se konduktometrija 87 koristila za mjerenje pKa lidokaina, iako je dobijeni rezultat bio 0,7 po jedinici ispod općeprihvaćene pH vrijednosti.

Albert i narednik su takođe opisali metodu za određivanje pKa iz merenja rastvorljivosti. Kao što je gore spomenuto, rastvorljivost zavisi od pKa, pa ako se rastvorljivost meri na više pH vrednosti na krivulji, pKa se može odrediti. Peck i Benet su opisali opću metodu za procjenu pKa vrijednosti za monoprotične, diprotične i amfoterne supstance dajući skup mjerenja rastvorljivosti i pH. Hansen i Hafliger su dobili pKa uzorka, kojibrzo se razgrađuje hidrolizom od svojih početnih brzina rastvaranja kao funkcije pH u uređaju s rotirajućim diskom. Rezultat se dobro slaže sa pH/UV rezultatom, ali razgradnja otežava potonju metodu. Ovo je, uglavnom, opis konduktometrijske metode analize.






