Termodinamika je važna grana fizike. Možemo sa sigurnošću reći da su njegova dostignuća dovela do pojave tehnološke ere i u velikoj mjeri odredila tok ljudske historije u posljednjih 300 godina. U članku se govori o prvom, drugom i trećem zakonu termodinamike i njihovoj primjeni u praksi.
Šta je termodinamika?
Pre nego što formulišemo zakone termodinamike, hajde da shvatimo šta radi ovaj deo fizike.
Reč "termodinamika" je grčkog porekla i znači "kretanje usled toplote". Odnosno, ova grana fizike se bavi proučavanjem bilo kojeg procesa, zbog čega se toplotna energija pretvara u mehaničko kretanje i obrnuto.
Osnovni zakoni termodinamike formulisani su sredinom 19. veka. Nauka o "kretanju i toploti" razmatra ponašanje čitavog sistema kao celine, proučavajući promene njegovih makroskopskih parametara - temperature, pritiska i zapremine, ne obraćajući pažnju na njegovu mikroskopsku strukturu. Štaviše, prvi od njih igra fundamentalnu ulogu u formulisanju zakonatermodinamika u fizici. Zanimljivo je primijetiti da su oni izvedeni isključivo iz eksperimentalnih zapažanja.
Koncept termodinamičkog sistema

Označava bilo koju grupu atoma, molekula ili drugih elemenata koji se smatraju kao cjelina. Sva tri zakona su formulisana za takozvani termodinamički sistem. Primeri su: Zemljina atmosfera, bilo koji živi organizam, mešavina gasova u motoru sa unutrašnjim sagorevanjem, itd.
Svi sistemi u termodinamici pripadaju jednom od tri tipa:
- Otvori. Oni razmjenjuju i toplinu i materiju sa okolinom. Na primjer, ako se hrana kuha u loncu na otvorenoj vatri, onda je ovo živopisan primjer otvorenog sistema, jer lonac prima energiju iz vanjskog okruženja (vatre), dok sam zrači energiju u obliku topline, a iz njega isparava i voda (metabolizam).
- Zatvoreno. U takvim sistemima nema razmene materije sa okolinom, iako dolazi do razmene energije. Da se vratimo na prethodni slučaj: ako čajnik pokrijete poklopcem, možete dobiti zatvoreni sistem.
- Isolated. Ovo je vrsta termodinamičkih sistema koji ne razmjenjuju materiju ili energiju sa okolnim prostorom. Primjer bi bila termosica u kojoj se nalazi topli čaj.
Termodinamička temperatura

Ovaj koncept znači kinetičku energiju čestica koje formiraju okolna tijela, što odražava brzinunasumično kretanje čestica. Što je veći, to je viša temperatura. Shodno tome, smanjenjem kinetičke energije sistema, mi ga hladimo.
Ovaj koncept označava kinetičku energiju čestica koje formiraju okolna tijela, što odražava brzinu haotičnog kretanja čestica. Što je veći, to je viša temperatura. Shodno tome, smanjenjem kinetičke energije sistema, mi ga hladimo.
Termodinamička temperatura je izražena u SI (Međunarodni sistem jedinica) u Kelvinima (u čast britanskog naučnika Williama Kelvina, koji je prvi predložio ovu skalu). Razumijevanje prvog, drugog i trećeg zakona termodinamike nemoguće je bez definicije temperature.
Podjela jednog stepena na Kelvinovoj skali također odgovara jednom stepenu Celzijusa. Konverzija između ovih jedinica se vrši prema formuli: TK =TC + 273, 15, gdje je TK i TC - temperature u kelvinima i stepenima Celzijusa.
Posebnost Kelvinove skale je da nema negativne vrijednosti. Nula u njemu (TC=-273, 15 oC) odgovara stanju kada je termičko kretanje čestica sistema potpuno odsutno, izgleda da su "zamrznuti".
Očuvanje energije i 1. zakon termodinamike

Godine 1824, Nicolas Léonard Sadi Carnot, francuski inženjer i fizičar, dao je hrabru sugestiju koja ne samo da je dovela do razvoja fizike, već je postala i veliki korak u poboljšanju tehnologije. Njegovomože se formulisati na sljedeći način: "Energija se ne može stvoriti ili uništiti, može se samo prenijeti iz jednog stanja u drugo."
U stvari, izraz Sadi Carnot-a postulira zakon održanja energije, koji je činio osnovu 1. zakona termodinamike: "Kad god sistem prima energiju izvana, on je pretvara u druge oblike, glavni od koji su termički i mehanički."
Matematička formula za 1. zakon je napisana na sljedeći način:
Q=ΔU + A, ovde Q je količina toplote koju okolina prenosi sistemu, ΔU je promena unutrašnje energije ovog sistema, A je savršen mehanički rad.
Adijabatski procesi
Dobar primjer za njih je kretanje vazdušnih masa duž planinskih padina. Takve mase su ogromne (kilometara ili više), a zrak je odličan toplotni izolator. Navedena svojstva nam omogućavaju da sve procese sa vazdušnim masama koji se odvijaju u kratkom vremenu smatramo adijabatskim. Kada se zrak diže uz planinsku padinu, njegov pritisak pada, širi se, odnosno obavlja mehanički rad, i kao rezultat toga, hladi se. Naprotiv, kretanje vazdušne mase naniže je praćeno povećanjem pritiska u njoj, ona se sabija i zbog toga postaje veoma vruća.
Primjena zakona termodinamike, o kojoj je bilo riječi u prethodnom podnaslovu, najlakše je demonstrirati na primjeru adijabatskog procesa.
Prema definiciji, kao rezultat toga nema razmene energije saokruženje, odnosno u gornjoj jednačini, Q=0. Ovo dovodi do sljedećeg izraza: ΔU=-A. Znak minus ovdje znači da sistem obavlja mehanički rad smanjujući vlastitu unutrašnju energiju. Treba podsjetiti da je unutrašnja energija direktno zavisna od temperature sistema.
Smjer termičkih procesa
Ovo izdanje se bavi 2. zakonom termodinamike. Sigurno su svi primijetili da ako dovedete u kontakt dva predmeta sa različitim temperaturama, onda će se hladni uvijek zagrijati, a vrući ohladiti. Imajte na umu da se obrnuti proces može dogoditi u okviru prvog zakona termodinamike, ali se nikada ne primjenjuje u praksi.
Razlog nepovratnosti ovog procesa (i svih poznatih procesa u Univerzumu) je prelazak sistema u vjerovatnije stanje. U razmatranom primjeru sa kontaktom dva tijela različitih temperatura, najvjerovatnije stanje će biti ono u kojem će sve čestice sistema imati istu kinetičku energiju.
Drugi zakon termodinamike može se formulisati na sledeći način: "Toplota se nikada ne može spontano preneti sa hladnog tela na toplo." Ako uvedemo koncept entropije kao mjere nereda, onda se to može predstaviti na sljedeći način: "Svaki termodinamički proces se odvija s povećanjem entropije".
Toplotni motor

Ovaj pojam se podrazumijeva kao sistem koji, zbog dovoda vanjske energije u njega, može obavljati mehanički rad. Prvotoplotne mašine su bile parne mašine i izumljene su krajem 17. veka.
Drugi zakon termodinamike igra odlučujuću ulogu u određivanju njihove efikasnosti. Sadi Carnot je takođe ustanovio da je maksimalna efikasnost ovog uređaja: Efikasnost=(T2 - T1)/T2, ovdje T2 i T1 su temperature grijača i frižidera. Mehanički rad se može obaviti samo kada postoji tok toplote iz vrućeg tijela u hladno, a taj tok se ne može 100% pretvoriti u korisnu energiju.
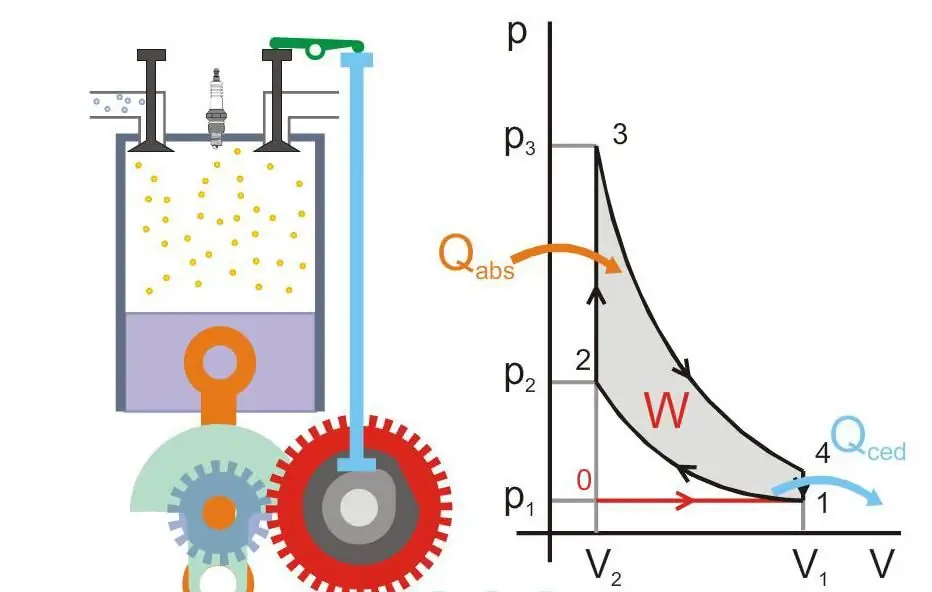
Slika ispod pokazuje princip rada toplotnog motora (Qabs - toplota preneta na mašinu, Qced - gubitak toplote, W - koristan rad, P i V - pritisak i zapremina gasa u klipu).
Apsolutna nula i Nernstov postulat
Konačno, pređimo na razmatranje trećeg zakona termodinamike. Naziva se i Nernstovim postulatom (ime njemačkog fizičara koji ga je prvi formulisao početkom 20. stoljeća). Zakon kaže: "Apsolutna nula se ne može postići sa konačnim brojem procesa." Odnosno, nemoguće je na bilo koji način potpuno "zamrznuti" molekule i atome supstance. Razlog tome je stalna postojeća izmjena toplote sa okolinom.

Jedan koristan zaključak izvučen iz trećeg zakona termodinamike je da entropija opada kako se krećemo prema apsolutnoj nuli. To znači da sistem teži da se sam organizuje. Ova činjenica možekoristiti, na primjer, za prijenos paramagneta u feromagnetno stanje kada se ohlade.
Zanimljivo je napomenuti da je najniža temperatura koja je do sada dostignuta iznosi 5·10−10 K (2003, MIT laboratorija, SAD).






